 En este artículo el autor estudió el comportamiento que expone el benzoato básico de aluminio como pigmento inhibidor de la corrosión del acero y su aplicación en pinturas anticorrosivas.
En este artículo el autor estudió el comportamiento que expone el benzoato básico de aluminio como pigmento inhibidor de la corrosión del acero y su aplicación en pinturas anticorrosivas.
por Dr. Guillermo Blustein*
Su acción inhibidora, en suspensión acuosa, se determinó mediante ensayos electroquímicos (potencial de corrosión y ensayos de polarización lineal) y técnicas de análisis superficial (SEM y EDAX), sobre electrodos de acero SAE 1010. Luego de comprobada la eficiencia anticorrosiva de este producto, se formularon pinturas anticorrosivas que fueron aplicadas sobre paneles de acero.
La eficiencia protectora se evaluó mediante ensayos de envejecimiento acelerado (cámara de niebla salina) y electroquímicos (espectroscopia de impedancia electroquímica).
Los resultados obtenidos indican que las pinturas formuladas con este nuevo pigmento exhiben una capacidad anticorrosiva similar o superior que las formuladas con pigmentos no tóxicos clásicos (ejemplo: fosfato de zinc), especialmente en pinturas base acuosa; lo cual lo perfila como un excelente substituto de los pigmentos anticorrosivos empleados hasta el presente.
Análisis inicial
Las pinturas anticorrosivas tradicionalmente empleadas que contienen pigmentos a base de compuestos de cromo y de plomo han sido cuestionadas en los países desarrollados por su elevada peligrosidad para la salud y polución del medio ambiente. Actualmente existe una tendencia mundial a eliminar dichos pigmentos y reemplazarlos por otros con bajo impacto ambiental [1].
En la búsqueda de nuevos pigmentos anticorrosivos, amigables con el medio ambiente y con buenas propiedades inhibitorias de la corrosión, se pensó estudiar los benzoatos metálicos. Esta elección no fue arbitraria sino que estuvo sustentada en la hipótesis de poder aprovechar las conocidas propiedades inhibitorias de la corrosión que posee el anión benzoato en medio acuoso.
Las propiedades del anión benzoato para inhibir la corrosión del hierro son bien conocidas en base a estudios realizados oportunamente y que empleaban benzoato de sodio y ácido benzoico en distintos medios, incluyendo aquéllos que contienen el anión cloruro [2-16].
También ha sido reportado el empleo del benzoato en mezclas con otros aniones inhibidores como el gluconato y el acetato [17] y, más recientemente, la posibilidad de utilizar también el benzoato de calcio en medios neutros [18]. Además de los estudios realizados sobre acero, el benzoato de sodio y el ácido benzoico se han empleado con éxito sobre otros metales tales como aluminio [19-23], cinc [24, 25], cobre [26] y bismuto [27].
El mecanismo de electro-adsorción del benzoato ha sido estudiado sobre electrodos de oro [28, 29] y el del ácido benzoico sobre electrodos de platino [30], cobre [31] y plata [32]. Estos estudios aportaron mucho al mecanismo propuesto para el acero con los mismos inhibidores, el cual comienza con la adsorción del inhibidor sobre los sitios activos de la superficie metálica, produciendo un cubrimiento efectivo de la misma y, por ende, un notable descenso de la velocidad de corrosión [33, 34].
También ha sido reportado el uso del benzoato de amonio como un inhibidor de la corrosión del hierro en fase gaseosa [35], generalmente en pequeños instrumentos embalados para su transporte.
Las sales solubles del ácido benzoico fueron utilizadas también en el campo de la tecnología del hormigón como aditivos inhibidores de la oxidación de las barras de refuerzo [36, 37], y en el de los recubrimientos orgánicos. En este último, las aplicaciones han sido diversas y entre ellas podría citarse su empleo en aditivos inhibidores del denominado “flash rusting” que se produce durante el pintado del acero con pinturas base acuosa [38-45], en compuestos biológicamente activos para pinturas antiincrustantes [46-49], etc.
El empleo del ácido benzoico y del benzoato de sodio como pigmentos inhibidores en pinturas anticorrosivas no es posible dado que su elevada solubilidad produciría una rápida lixiviación desde la película, dejándola rápidamente sin reserva de inhibidor y aumentando excesivamente su permeabilidad, con la consecuente pérdida de sus propiedades protectoras. Por otro lado, compuestos excesivamente insolubles no aportarían la cantidad suficiente de anión para una protección adecuada. En este sentido, el presente trabajo estuvo orientado a lograr la síntesis de benzoatos metálicos, en particular del benzoato básico de aluminio para satisfacer las restricciones mencionadas y así ser incorporado a la formulación de una cubierta anticorrosiva.
Cabe mencionar que la elección de este anión atiende no sólo a lo anteriormente señalado sino también a razones económicas (es un producto industrial de bajo costo) y ecológicas (el ácido benzoico y el benzoato de sodio son ampliamente utilizados como aditivos para la conservación de alimentos de consumo humano).
Parte experimental
- Preparación y caracterización del benzoato de aluminio: Este compuesto fue preparado en el laboratorio mediante precipitación a partir de benzoato de amonio y nitrato férrico, ajustando a un pH final de 3,5 [50]. El pigmento fue caracterizado en lo que respecta a su composición y pH del extracto acuoso.
Paralelamente se determinó el potencial de corrosión en función del tiempo para probetas de acero SAE 1010 sumergidas en una suspensión del inhibidor en NaClO4 0,025 M, con y sin óxido de cinc. Las curvas de polarización fueron obtenidas en electrolitos formados por suspensiones de benzoato de aluminio con y sin óxido de cinc en NaClO4 0,5M. Se utilizó una celda convencional de tres electrodos con un contraelectrodo de platino de gran área y un electrodo de calomel saturado como referencia. Como electrodo de trabajo se empleó acero SAE 1010 incluido en teflón, con un área expuesta de 0,20cm2 y pulido con esmeril 600. La velocidad de barrido fue de 0,003V.s-1 en todos los casos.
Finalmente se estudió la morfología y composición de las películas protectoras formadas sobre el acero luego de su inmersión en las suspensiones del pigmento inhibidor, en presencia y ausencia de óxido de cinc, mediante microscopía electrónica de barrido (SEM) acoplado con la sonda EDAX.
- Formulación, elaboración y aplicación de las pinturas: Las pinturas fueron formuladas con un contenido de pigmento anticorrosivo de 30% en volumen sobre el total de pigmentos. Como pigmentos complementarios fueron usados dióxido de titanio, talco y barita; los ligantes, una resina alquídica y una epoxi/poliamídica (pinturas base solvente) y una resina epoxi poliamino-amida (pintura base acuosa); los solventes aguarrás mineral para las pinturas alquídicas, xileno/metil isobutil cetona/acetato de butilo para las epoxídicas base solvente y agua para la epoxídica base acuosa. Las pinturas base solvente fueron preparadas en un molino a bolas de 1l de capacidad y la pintura base acuosa en una dispersora de alta velocidad. Las pinturas fueron aplicadas con pincel hasta un espesor final de película seca de 70+_5m, sobre probetas de acero SAE 1010 previamente arenadas y desengrasadas con tolueno.
- Ensayos sobre paneles pintados: La eficiencia protectora de las pinturas se evaluó periódicamente a través del grado de oxidación (ASTM D 610) que presentaban los paneles pintados expuestos en la cámara de niebla salina (ASTM D 117).
La protección brindada por el pigmento anticorrosivo fue monitoreada a través de medidas de impedancia electroquímica, las cuales se llevaron a cabo en una celda convencional de tres electrodos. La probeta pintada era el electrodo de trabajo, una malla de Pt-Rh de impedancia despreciable el contra electrodo y un electrodo de calomel saturado (ECS) el de referencia. Los espectros de impedancia en función del tiempo de inmersión en una solución de NaClO4 0,5 M y NaCl 0,5 M fueron realizados en el modo potenciostático, al potencial de corrosión, en el rango de frecuencia 5.10‑3Hz<f<1.106Hz; la amplitud de la señal fue de 10mV. El procesa-miento de los datos fue llevado a cabo mediante un conjunto de programas desarrollados por Boukamp [51].
Resultados y discusión
- Caracterización química: La relación estequiométrica existente entre el catión Al+3 y el anión benzoato sugiere que la fórmula mínima del compuesto formado es Al(C7H5O2)2OH [50].
El pH de la suspensión de benzoato de aluminio (~ 3,58) demuestra que por sí solo no es apto para formular una pintura dado que la protección del acero comienza a pH 7. Por ello se adicionó óxido de cinc para elevar el pH (~ 6,86) y de esta forma conducir a la formación de una película protectora eficiente. Además, el catión Zn++ polariza las áreas catódicas por precipitación de oxihidróxidos de cinc.
- Caracterización electroquímica: Debido a la alta acidez hidrolítica que presenta el benzoato de aluminio, el potencial de corrosión del acero en una suspensión del mismo presenta valores típicos de del acero en franca disolución (~ -0,50V vs. ECS). La incorporación de ZnO produjo un desplazamiento notable del potencial de corrosión hacia valores más nobles (~ -0,20V vs. ECS), es decir hacia la zona de pasividad. Este corrimiento es mayor que cuando el potencial de corrosión es medido sólo en presencia de óxido de cinc (~ -0,35V vs. ECS) lo cual demuestra claro sinergismo entre ambos pigmentos, ver Fig. 1.
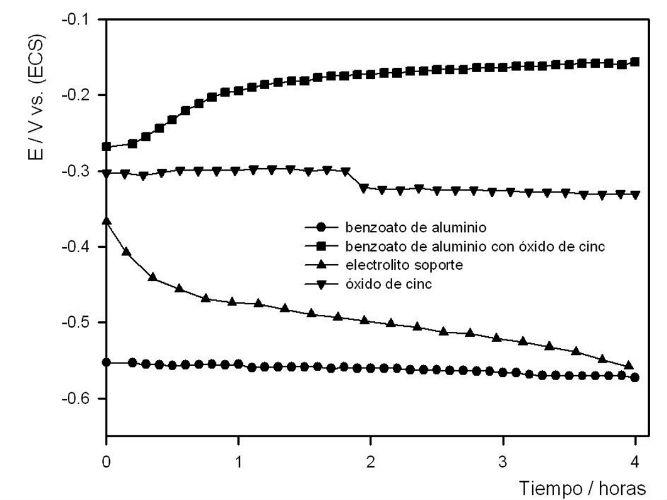
Fig. 1. Potencial de corrosión del acero.
La curvas de polarización de tafel muestran que en ausencia de óxido de cinc, la corriente de corrosión es elevada y el acero en este medio está en franca disolución, Fig. 2. Nuevamente, la incorporación de óxido de cinc disminuyó notablemente la corriente de corrosión como se observa claramente en la Figura 2.
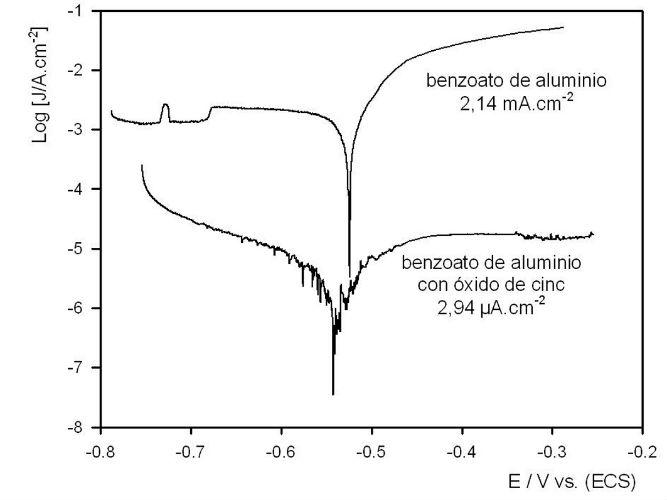
Fig. 2. Curvas de polarización.
Nota: El presente artículo representa una parte del trabajo de tesis doctoral del Dr. Guillermo Blustein presentada en la Facultad de Ciencias Exactas-Universidad nacional de La Plata.
* Dr. Guillermo Blustein* CIDEPINT- Centro de Investigación y Desarrollo en Tecnología de Pinturas Calle 52 e/ 121 y 122 (B1900AYB) La Plata. Argentina. [email protected]
Referencias
1. S. Krieg. Lead and chromate free anticorrosive pigments based on phosphates. Pitt. & Vern., 1996, 72 (12), 18.
2. D. Eurof Davies and Q. J. M. Slaiman. Mechanism of the corrosion inhibition of Fe by sodium benzoate – I. The influence of concentration and pH in air-saturated solutions of sodium benzoate. Corr. Sci. 11 1971 p 671.
3. Q. J. M. Slaiman and D. Eurof Davies. Mechanism of the corrosion inhibition of Fe by sodium benzoate –II. The inhibitive properties of sodium benzoate in de-aerated and air-saturated solution. Corr. Sci. 11 1971 p. 683.
4. D. Eurof Davies and Q. J. M. Slaiman. Mechanism of the corrosion inhibition of iron by sodium benzoate – III. The role of oxygen. Corr. Sci. 13 (11)1973 p. 891.
5. V.S. Muralidharan, R. Sethuraman, S.Krishnamoorthy. Benzoic acid as corrosion inhibitors for pure iron in sulphuric acid. Bull. Electrochem. 4 1988 p 705.
6. D. S. Azambuja, L. R. Holzle, I. L. Muller and C. M. S. Piatnicki. Electrochemical behaviour of iron in neutral solutions of acetate and benzoate anions. Corr. Sci. 41 (11) 1999 p. 2083.
7. Masahiko Yamaguchi, Hiroshi Nishihara and Kunitsugu Aramaki. The inhibition of passive film breakdown on iron in a borate buffer solution containing chloride ions by anion inhibitors. Corr. Sci. 36 (2) 1994 p. 241.
8. Mübeccel Ergun and Ya Sar Turan. Pitting potential and protection potential of carbon steel for chloride ion and the effectiveness of different inhibiting anions. Corr. Sci. 32 (10) 1991 p. 1137.
9. V. Otieno-Alego, G. A. Hope, H. J. Flitt, G. A. Cash and D. P. Schweinsberg. The effect of potential scan on the parameters used to synthesize anodic polarization curves. Corr. Sci. 33 (11) 1992 p. 1719.
10. R. Kahraman, A.A. Al-Mathami, H. Saricimen, N. Abbas and S.U. Arman. A study of corrosion control of carbon steel using inhibitors in a simulated enviroment. Anti-Corrosion Methods and Materials 49 (5) 2002 p. 346.
11. P. Argawal and D. Landolt. Effect of anions on the efficiency of aromatic carboxylic acid corrosion inhibitors in near neutral media: Experimental investigation and theoretical modeling. Corr. Sci. (4/5) 1998 p. 673.
12. Kahraman R. Inhibition of atmospheric corrosion of mild steel by sodium benzoate treatment. J. Mat. Eng. and Performance 11 (1) 2002 p. 46.
13. K. Takahashi, J. A. Bardwell, B. Mac Dougall and M. J. Graham. Mechanism of anodic dissolution and passivation of iron--II. Comparison of the behavior in neutral benzoate and acetate buffer solutions. Electrochimica Acta 37 (3) 1992 p. 489.
14. J. R. Culleré y M. Lluveras. Mecanismo de la acción inhibidora del benzoato sódico. Rev. Iberoam. Corr. Prot. 1983 p. 225.
15. Gianluca Bondietti, Jürg Sinniger and Werner Stumm. The reactivity of Fe (III) (hydr)oxides: Effects of ligands in inhibiting the dissolution. Colloids and Surfaces A: Physicochemical and Engineering Aspect 79 (2-3) 1993 p. 157.
16. R. Kahraman, H. Saricimen, Al-Zahrani and S. Al-Dulaijan. Effect of inhibitor treatment on corrosion of steel in a salt solution. J. Mat. Eng. Performance 12 (5) 2003 p. 524.
17. O. Lahodny-Šarc and F. Kapor. Corrosion inhibition of carbon steel by blends of gluconate/benzoate at temperatures up to 60ºC. Mat. Sci. Forum 289-292 1998 p. 1205.
18. G. Blustein, J. Rodríguez, R. Romagnoli and C. F. Zinola. Inhibition of steel corrosion by calcium benzoate adsorption in nitrate solutions. Corr. Sci. 47 (2005) 369 –383
19. P. N. S. Yadav, A. K. Singh and R. Wadhwani. Role of hydroxyl group in the inhibitive action of benzoic acid towards corrosion of aluminium in nitric acid. Corrosion (NACE) 55 (10)1999 p. 937.
20. Raspini. Influence of sodium salts of organic acid as additives on localized corrosion of aluminium and its alloys. Corrosion (NACE) 49 (10)1993 p. 821.
21. A.K. Mohamed, S.A. Abd El-Maksoud and A.S. Fonda. p-Substituted benzoic acid derivatives as corrosion inhibitors for aluminium in H3PO4. Portugaliae Electrochimica Acta 15 1997 p. 27.
22. Sibel Zor. The effects of benzoic acid in chloride solutions on the corrosion of iron and aluminium. Turk J. Chem. 26 2002 p. 403.
23. W. J. Rudd and Scully. The function of the repassivation process in the inhibition of pitting corrosion on aluminium. Corr. Sci. 20 (5)1980 p. 611.
24. Kanitsugu Aramaki. Effects of organic inhibitors on corrosion of zinc in aerated 0.5 M NaCl solution. Corr. Sci. 43 (10) 2001 p. 1985.
25. S. M. Abd El Haleem and A. A. Abdel Fattah. The role of some organic anions in promoting or inhibiting the corrosion of zinc. Surf. Coat. Technol. 29 (1) 1986 p. 41.
26. S. N. Mostafa, M. Y. Mourand and S. A. Seliman. Electrochemical studies on the corrosion of cooper in organic electrolyte solutions. J. Electroanal. Chem. 130 1981 p. 221.
27. A. Ammar and M. W. Khalil. Behaviour of bismuth as valve metal in phosphate, borate, benzoate and tartrate solutions. J. Electroanal. Chem.32 (3) 1971 p. 373.
28. Hong-Qiang Li, Sharon G. Roscoe and Jacet Lipkowski. FTIR studies of benzoate adsorption on the Au (111) electrode. J. Electroanal. Chem.478 (1-2) 1999 p. 67.
29. P. Zelenay, P. Waszczuk, K. Dobrowolska and J. Sobkowski. Adsorption of benzoic acid on a polycrystalline gold electrode. Electrochimica Acta 39 (5) 1994 p. 655.
30. P. Zelenay, and J. Sobkowski. Electrosorption of benzoic acid on platinum electrode. Electrochimica Acta 29 (12) 1984 p. 1715.
31. P. Waszczuk, P. Zelenay, and J. Sobkowski. Surface interaction of benzoic acid with a cooper electrode. Electrochimica Acta 40 (11) 1995 p. 1717.
32. P. Waszczuk, P. Zelenay and J. Sobkowski. Radiometric and voltammetric study of benzoic acid adsorption on a polycrystalline silver electrode. Electrochimica Acta 43 (14-15) 1998 p. 1963.
33. G. Blustein and C. F. Zinola. Inhibition of steel corrosion by calcium benzoate adsorption in nitrate solutions: theoretical and experimental approach. J. Colloid and Interface Sci. 278 (2004) 393-403
34. P. Kern and D. Landolt. Adsorption of organic corrosion inhibitors on iron in the active and passive state. A replacement reaction between inhibitor and water studied with the rotating quartz crystal microbalance. Electrochimica Acta 47 (4) 2001 p. 589.
35. A. Leng and Stratmann. The inhibition of the atmospheric corrosion of iron by vapour-phase-inhibitors. Corr. Sci. 34 (10) 1993 p. 1657.
36. Monticelli, A. Frignani and G. Trabanelli. A study on corrosion inhibitors for concrete application. Cement and Concrete Researcher 30 2000 p. 635.
37. James M. Gaidis. Chemistry of corrosion inhibitors. Cement & Concrete Composites 26 2004 p. 181.
38. F. Galliano and D. Landolt. Evaluation of corrosion protection properties of additives for waterborne epoxy coatings on steel. Prog. Org. Coat. 44 (3) 2002 p. 217.
39. S. A Hodges, W. M. Uphues and M. T. Tran. Non-toxic corrosion inhibitive synergistic system. Surf. Coat. Intern.4 1997 p. 178.
40. C.H. Simpson. US Navy Develops Non-toxic, self-priming coatings for aluminium and steel. Paint & Coatings Industry 1993.
41. M.A. Jackson. Formulation of waterborne epoxy primers: An evaluation of anticorrosive pigment. J. Protective Coating and Lining 1990.
42. Andréa Kalendová. Methods for testing and evaluating the flash corrosion. Prog. Org. Coat. 44 (3) 2002 p.201.
43. Halox® Flash-X330 Halox Flash Rust Inhibitors.
44. Gail Pollano and Amy Lurier (Polyvinyl Chemicals Inc.). Factors affecting salt spray resistance of an aqueous coating on metal. Paint & Coatings Industry May/June 1987.
45. S. Gee, Surf. Coat. Intern. 80 (1997) 316.
46. I. Chet, P. Asketh, and R. Mitchell. Repulsion of bacteria from marine surfaces. Applied Microbiology. 30 1975 p. 1043.
47. Mirta Stupak, Mónica García, Miriam C. Pérez. Non-toxic alternative compounds for marine antifouling paints. International Biodeterioration & Biodegradation 52 2003 p. 49.
48. V. Vetere, M. Pérez, M. García, M. Deyá, M. Stupak and B. del Amo. A non-toxic antifouling compound for marine paints. Surf. Coat. Intern. 12 1999 p. 586.
49. M. Pérez, M. García, V. Vetere, M. Deyá, B. del Amo and M. Stupak. Benzoates: a new approach to non-toxic marine fouling control. Pigment & Resin Technology 30 (1) 2001 p. 34.
50. Blustein, G., “Desarrollo de inhibidores a base de benzoatos metálicos para la protección anticorrosiva del acero”, Tesis de Doctorado, Dpto. de Química, Universidad Nacional de La Plata, La Plata, Argentina (2005).
51. Boukamp, B.A., Report CT88/265/128, CT89/214/128, Equivalent Circuit, University of Twente, The Netherlands (1989).
52. M.C. Deyá, G. Blustein, R. Romagnoli and B. del Amo. The influence of the anion type on the anticorrosive behaviour of inorganic phosphates. Surf. Coat. Technol. 150 (2-3), 2002 133-142.
53. G. Blustein, B. del Amo and R. Romagnoli. The influence of the solubility of zinc phosphate pigments on their anticorrosive behaviour. Pig. & Res. Technol. 29(2) 2000 100-107.ence: 41, 2083-2097 (1999).
























Deje su comentario